EL CONCEPTO DE MOL Y SUS APLICACIONES
¿ Qué cantidad de átomos del elemento hay en el Peso Atómico del elemento expresado en gramos?
Daremos la respuesta más simple, en base a un experimento también simple esquematizado en el siguiente gráfico.
En el Peso Atómico de un elemento expresado en gramos existen 6,023 .10 23 átomos del Elemento.
DEFINICIÓN DE MOL
Un Mol es 6,023 10 23 unidades.
NUEVA DEFINICIÓN DE PESO ATOMICO
El Peso Atómico de un elemento ( A r ) es la masa de un mol de átomos de tal elemento expresada gramos.
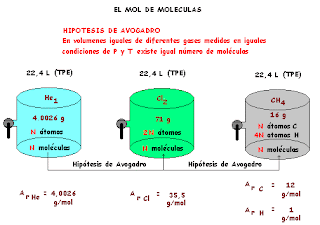
EL MOL DE MOLECULAS
Volvamos a nuestra experiencia de recolección de Helio puesto que podemos sacar mucho más provecho de ella y coloquemos a nuestro sistema en situación comparativa con otros.
DEFINICIÓN DE PESO MOLECULAR
El Peso Molecular ( M r ) de una sustancia es la masa de un mol de moléculas de tal sustancia expresada en gramos.
CALCULO DEL PESO MOLECULAR
Generalizando, si una Sustancia tiene por Fórmula AaBbCc........
A nivel submicroscópico su molécula está formada por a átomos de A, b átomos de B y c átomos de C etc...
y a nivel macroscópico el mol de moléculas está formada por a moles de átomos de A, b moles de átomos de B y c moles de átomos átomos de C etc... y de allí que el Peso Molecular se calcule con la siguiente fórmula.
Mr AaBbCc........ = a * Ar A + b * Ar B + c * Ar C +........
¿Cuánto vale el Peso molecular del Cloroformo CHCl3?
Mr CHCl3 = 1 *12 + 1 * 1 + 3 * 35,5 = 119,5 g/mol
LA ECUACIÓN DE ESTADO DE LOS GASES IDEALES.
Para dar adecuada respuesta a la pregunta planteada es necesario averiguar las relaciones matemáticas que expresan el comportamiento de las distintas variables que determinan el estado de un sistema gaseoso. Un sistema gaseoso se encuentra en un estado definido cuando, además de precisarse la naturaleza del gas, se conocen tres de las siguientes cuatro variables:
n = Número de moles, V = Volumen, P = Presión y t = temperatura.
Para comenzar el estudio de las relaciones es conveniente definir el Volumen Molar
Volumen Molar = V = V / n (L/mol)
MÉTODO DE DETERMINACIÓN DEL PESO MOLECULAR
La determinación experimental del valor de Mr es de fundamental importancia cuando no se conoce la fórmula de alguna sustancia. Si la sustancia se puede evaporar podemos aplicar la ecuación anterior pero para calcular el Peso Molecular.
Mr = densidad P,T RT /
P